A pressão máxima de vapor
Ponto de ebulição: é a temperatura na qual a pressão máxima de vapor de um liquida iguala-se á pressão atmosférica ambiente.
Ponto de ebulição: é a temperatura na qual a pressão máxima de vapor de um liquida iguala-se á pressão atmosférica ambiente.
Essa definição ponto de ebulição de um líquido depende necessariamente da pressão atmosférica local.
A pressão máxima de vapor depende da natureza do liquido.
Alguns líquidos voláteis, como o éter, o álcool e a gasolina, tem maior facilidade para evaporar, portanto suas pressões máximas de vapor são maiores quando comparadas com a da água, na mesma temperatura.
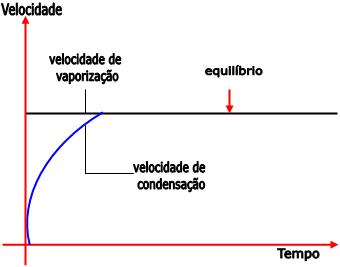
A velocidade de condensação torna-se igual à velocidade de vaporização no equilíbrio, ou seja, o número de moléculas que abandonam o líquido se iguala ao número de moléculas que voltam para o líquido.
A pressão máxima do vapor também pode ser chamada de pressão de vapor ou pressão de vapor de equilíbrio. Tal pressão é aquela que é exercida pelo vapor em equilíbrio com o seu líquido.
Quando o vapor está em equilíbrio com o seu líquido, ele é denominado vapor saturante.
Sobrefusão
Às vezes acontece de abrirmos uma garrafa ou lata de bebidas recém-tirada do congelador ou freezer, onde sabemos que a temperatura é bem inferior ao ponto de solidificação da água e, no entanto, a bebida encontra-se no estado liquido.
À medida que a temperatura diminui as partículas do liquido vão se tornando mais lentas e, eventualmente, podemos movimentar-se formando cristais. Se a queda da temperatura for suficientemente lenta, pode ocorrer de as partículas do liquido não formarem esses cristais e ficarem “imobilizados” nas suas posições.
Fonte:
livro de física, volume 2
Editora Saraiva




